Nome IUPAC: Aminobenzeno
Outros nomes: Fenilamina, Anilina
Fórmula molecular: C6H7N
Aparência: líquido incolor
Densidade: 1.0217 g/ml, líquido
Ponto de fusão: −6.3 °C
Ponto de ebulição: 184.13 °C
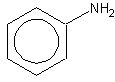

Características:
A anilina pertence à classe orgânica das amidas e foi descoberta em 1826 por Otto Unverdorben (1806-1873) quando tinha apenas 20 anos, tendo a chamado primeiro de Crystallin e foi inicialmente preparada a partir da destilação seca do anil ou do índigo.
É um composto orgânico um líquido incolor ligeiramente amarelo, tem odor de peixe podre, característico de aminas aromáticas, sabor cáustico de veneno amargo. Facilmente inflamável é levemente solúvel em água, se dissolve na maioria dos compostos orgânicos.
A Anilina é uma substância muito venenosa, ocorre no alcatrão mineral, sendo utilizada na indústria da borracha e na síntese de fármacos e corantes. Esses corantes possuem cores intensas, um exemplo é o azul-de-metileno que é usado no coramento de células para serem vistas ao microscópio. A Anilina é também usada na produção de sais de diazônio e de medicamentos.
Como todo composto aromático, a anilina possui vapores tóxicos se inalados. Ela pode se combinar com a hemoglobina do sangue impedindo que o oxigênio seja transportado. Como todo composto aromático, a anilina queima rapidamente gerando uma chama muito ampla.

Reações
A anilina é uma base fraca, recebendo um H+ no grupamento NH2 que se torna NH3+. Isso faz com que ela reaja bem com diversos ácidos fortes, que geralmente são inorgânicos.
A anilina pode sofrer reações de diversos tipos, algumas delas até mesmo espontâneas, como a oxidação que ocorre caso se deixe o frasco de anilina aberto fazendo com que ela adquira uma coloração que vai de amarelo escuro a marrom.
Uma reação conhecida desse composto é a diazotação, responsável pela formação de sais de diazônio que são essenciais na síntese de corantes. Sendo um composto muito versátil, pode tomar parte em diversas reações como substituição eletrofílica direto no carbono. As reações que podem ocorrer no Nitrogênio são as reações de ácido-base, N- alquilação com etanol. Pode também ser reagido com nitrobenzeno (seu precursor para a formação de fenazina).
Sua produção se dá principalmente a partir da nitração do benzeno. Essa reação em laboratório é feita pela adição lenta de mistura sulfonítrica sobre o benzeno. Deve-se mantê-lo resfriado com banho de gelo já que essa é uma reação extremamente exotérmica. Como característica geral dos compostos nitrados, ele agora apresenta uma coloração amarelada. Essa etapa gera o nitrobenzeno, que é hidrogenado em altas temperaturas.

Curiosidades
A anilina é um químico importante na indústria da borracha. São usados em menores quantidades na produção de tintas, pesticidas, fármacos, resinas, vernizes, perfumes, químicos fotográficos, explosivos, difenilamina, fenóis e químicos usados na refinação de petróleo.
A população em geral pode estar exposta à anilina ao comer alimentos ou beber água que a contenham, no entanto as concentrações são geralmente muito pequenas quando comparadas com a anilina que se detecta quer no fumo do tabaco como em fábricas onde produtos como tintas, vernizes, herbicidas e explosivos são produzidos.
A anilina pode exercer toxicidade ao ser ingerido, inalada ou por simples contato com a pele. A anilina provoca metahemoglobinemia, pelo que o transporte de oxigênio pelo sangue é diminuído. A gravidade depende da quantidade e tempo de exposição à anilina. Este figura como sendo o sintoma mais significativo produzindo cianose (coloração azul púrpura da pele), náuseas, vômitos e diminuição da função respiratória. Podem também ocorrer dores de cabeça, irritabilidade, confusão, fraqueza, bem como sonolência. O contato direto com anilina pode produzir irritação da pele e dos olhos.
Fontes:
http://pt.wikipedia.org/wiki/Anilina
http://www.mundoeducacao.com.br/quimica/anilina.htm
http://www.infoescola.com/compostos-quimicos/anilina/