<div
<div


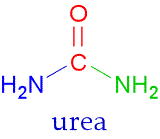
Nome:Ureia
Nome IUPAC: Diaminometanal
Nome popular: Carbamida
Descobridor: Hilaire Rouelle
Ano:1773
Formula Química: (NH2)2CO
Estado físico: Sólido cristalino em forma de perolas.
Forma: Sólido.
Cor: Branca.
Odor: Inodoro ou um leve odor de amônia.
pH: Levemente alcalino.
Temperaturas específicas:
Ponto de ebulição: Não aplicável.
Ponto de fusão: 132,7 ºC (dados de literatura).
Temperatura de auto-ignição: Não aplicável.
Limites de explosividade superior/inferior: Não aplicável
Pressão de vapor: Não aplicável.
Densidade de vapor: Não aplicável.
Densidade livre: 1,34 g/cm3.
Densidade aparente: 730 kg/m3.
Solubilidade (água): 78 g/100 ml (5 °C); 119.3 g/100 ml (25 °C).
Solubilidade (etanol): 72 g/1000 ml (30 ºC).
Coeficiente de partição octanol/água: Não aplicável.
Taxa de evaporação: Não aplicável.
Outras informações:-Peso molecular: 60,06
Identificação do produto e da empresa:
Nome da empresa: J. D. I. Comércio e Representações Ltda.
Chemical Abstract Service (nº CAS): 57-13-6
Identificação de perigos:
-Inalação: A poeira é irritante ao nariz, à garganta, e ao sistema respiratório, e pode causar tosse e espirros.
-Contato com a pele: O contato prolongado e repetido pode causar uma irritação suave.
-Contato com os olhos: Irritação, olhos vermelhos, e dor.
-Ingestão: A ingestão de quantidades grandes de poeira pode causar uma virada gastrointestinal e a dor
abdominal.
-Outros efeitos na saúde: Quando dissolvida em água assume forma de soluções corrosivas. Em
concentrações elevadas no sangue a uréia aumenta o risco do glaucoma.
Medidas de primeiros-socorros:
-Inalação: Remova a pessoa ao ar fresco. Se esta não estiver respirando, administre a respiração artificial. Se
respirar com dificuldade, administre o oxigênio. Encaminhar ao Médico.
Contato com a pele: Remova a substância da roupa. Lave as áreas afetadas com sabão. Se a irritação
persistir, procure um médico.
-Contato com os olhos: Lavar os olhos com água morna em abundância por pelo menos 15 minutos.
Encaminhar ao Médico.
Ingestão: Se a vitima não sofrer de convulsões, dar para ela 0,5 a 1L de água para diluir o material. Não
induza ao vômito, se a vitima vomitar, mantenha-a para a frente com a cabeça para baixo, vara
evitar que ela não respire sobre o vômito. Encaminhar ao médico imediatamente.
Ponto de fulgor: Não aplicável.
Ponto de auto ignição: Não aplicável.
Limites de inflamabilidade /explosividade: Não aplicável.
Procedimentos de combate ao fogo: Usar as medidas apropriadas para o combate do fogo da
circunvizinhança.
Perigos incomuns: A reação com nitratos apresenta o risco de fogo e explosão. A uréia não é um
combustível, mas se decompõem a temperaturas acima de 133°C formando vapores tóxicos.
Precauções pessoais:
Remoção de fontes de ignição: Apresenta risco de decomposição quando exposta ao calor ou chama.
Controle de poeira: Não aplicável.
Prevenção da inalação e do contato com a pele, mucosas e olhos: Utilize equipamentos de proteção
individual adequados.
Precauções ao meio ambiente: Em caso derramamento, o produto deverá ser recolhido, pois o contato
com em altas concentrações com a vegetação, causará danos à mesma. A queda em córregos ou rios deve
ser evitada, pois poderá torná-los impróprio para o consumo humano e de animais. Neste caso,
comunique o fato imediatamente ao órgão de Controle Ambiental da Região.
Sistemas de alarme: Não aplicável.
Métodos para limpeza: Em caso de vazamento pare ou reduza-o, se for seguro tomar esta ação.
Recuperação: Se possível realizar a transferência do produto.
Neutralização: Não aplicável.
Disposição: O produto é reaproveitado.
Prevenção de perigos secundários: Reveja orientações contidas nos campos anteriores.
Manuseio:
Medidas técnicas: Se as operações de manuseio gerarem a poeira ou névoa, usar ventilação para manter
a exposição aos contaminadores transportados por via aérea abaixo do limite da exposição.
Prevenção da exposição do trabalhador: Submeta todo sistema a um controle periódico de
manutenção. Mantenha equipe permanentemente treinada.
Prevenção de incêndio e explosão: Reveja orientações contidas nos campos anteriores.
Precauções para manuseio seguro: Para reduzir a possibilidade de risco potencial à saúde, assegure
ventilação diluídora suficiente ou existência de exaustão no local para controlar a concentração ambiente a
níveis baixos. Utilizar sempre os equipamentos de proteção individual.
Orientações para manuseio seguro: Evite contato com materiais incompatíveis e contaminações
ambientais, conforme mencionado nos campos anteriores.
Armazenamento:
Medidas técnicas apropriadas: Previna o contato com calor, faíscas e chamas.
Equipamento de proteção individual apropriado:
Proteção respiratória: no caso do contato apenas com a uréia, preferencialmente utilizar, mascaras
contra pó, em situações de emergência utilizar mascaras com alimentação de ar.
Proteção da pele: As luvas do algodão e a roupa protetora devem ser usadas. Proteção De Olho: Use
óculos de proteção de segurança química quando há potencial para o contato de olho.
O Outro Equipamento Protetor Pessoal: Requerido não geralmente.
Proteção de olho: Utilize óculos de segurança.
Efeitos ambientais, comportamentos e impactos do produto:
Mobilidade: A uréia é solúvel em água.
Persistência /degradabilidade: Substancialmente biodegradável em solo e água.
Bioacumulação: Baixo potencial para bioacumulação.
Comportamento esperado: Rápida dissipação da nuvem gasosa.
Impacto ambiental: Em caso de derramamento, o produto deverá ser recolhido, pois, o contato em alta
concentração com a vegetação, causará danos à mesma.A queda do produto em córregos e rios deve ser
evitada, pois poderá torná-los impróprio para o consumo humano e de animais. Neste caso, comunique o
fato imediatamente ao órgão de Controle Ambiental da Região.
Ecotoxicidade: Pouco tóxico para a vida animal e humana.
A adição da ureia se faz necessária para a solução ficar isenta de íonnitrico que impedem a deposição completa do cobre; logo, em uma solução eletrolítica a finalidade da ureia é remover vestígios dos íons nitrito.
Reação:
- 2H+ + 2NO2- + CO(NH2)2 → 2N2 + CO2 + 3H2O
Referências bibliográficas:
- Guidance for Compilation of Safety Data Sheets for Fertilizer Materials. European Fertilizer
Manufacturers’ Association (EFMA), 1996.
- Portaria Nº 3.214, Do Ministério do Trabalho.
- NIOSH, OSHA, ACGIH.
- NFPA
Nome: Fulereno

Nome popular: buckminsterfullereno
Nome IUPAC: Fulereno-C60
Fórmula Química: C60
Ano:1985
Nome(Descobridor):H. W. Kroto e R. E. Smalley
Aplicação:
Atividade antiviral, através da inibição do acesso de enzimas virais (e.g. Proteases do vírus HIV) ao substrato pelo preenchimento da cavidade hidrofóbica dos sítios catalíticos, [Zhu et al. 2003];
Atividade antioxidante e de armadilhas de radicais livres [Lai et al. 1997][Chiang et al. 1995][Chueu et al. 1997][Tsai et al. 1997];
Terapia fotodinâmica através da produção de oxigênio singleto e outros radicais livres [Kamat et al. 1998][Kamat et al. 2000][Vileno et al. 2004];
Foto-clivagem do DNA [Tokuyama et al. 1993][Higashi et al. 1997];
Atividade antimicrobiana (versus Candida albicans, Bacillus, Echerichia coli, Mycobacterium, mycobacterium avirum, staphylococcus spp,staphylococus , klebsilla, pneumoniae, salmonella typhy) por intercalação e desestruturação de membranas celulares [da Ros et al. 1996][Mashino et al. 1999];
Transporte de drogas de efeito radioterápico e contrastes para diagnóstico por imagem (Magnetic Resonance Imaging - MRI e tomografia por raios-X) [Bolskar et al. 2003][Cagle et al. 1999][Cagle et al. 1996][Braun and Rausch 2000][Thrash et al. 1999][Sueki et al. 2003].
Avanços recentes na química orgânica (veja e.g. [Hirsh 1994]) permitiram funcionalizar e adaptar estas moléculas para aplicações médicas, vencendo sua maior desvantagem: seu caráter apolar e sua repulsão natural por água. A hidrossolubilidade dos fulerenos foi um marco para a pesquisa e o desenvolvimento de aplicações biomédicas destas moléculas. Neste projeto nos concentraremos na investigação das propriedades antioxidantes e fotodinâmicas dos fulerenos e seus derivados hidrossolúveis, os fulerols.

1) Arquiteto

2) Cientista

3) cientista
Legendas: 1)Richard Buckminster Fuller 2)H. W. Kroto 3) R. E. Smalley
A descoberta dos fulerenos ocorreu em setembro de 1985 quando um grupo de cientistas, principalmente H. W. Kroto e R. E. Smalley, obtiveram uma série de estruturas químicas com 44 a 90 átomos de carbono, aparecendo em maior concentração aquelas com 60 átomos de carbono, a partir do lançamento deraios laserr sobre o grafite a uma temperatura de 104 °C. A descoberta do novo alótropo do carbono rendeu a estes cientistas o Prêmio Nobel de química em1996.Os fulerenos são a terceira forma mais estável do carbono, após o diamante e o grafite. Sua descoberta foi muito recente em1985, tornando-se populares entre os químicos, tanto pela sua beleza estrutural quanto pela sua versatilidade para a síntese de novos composto químico . Foram chamados de buckminsterfullerene em homenagem ao arquiteto R.buckminster Fuller que inventou a estrutura do dono geodésico, devido à semelhança, daí advindo a denominação antiga desta forma de carbono.
Fulerenos são uma vasta família de nanomoléculas superaromaticas, altamente simetricas, compostas de dezenas de átomos de carbono sp2-hibridizados. O representante mais conhecido da família dos fulerenos sendo o C60 (com 60 carbonos)mas também temos fulerenos com quantidades diferentes de átomos de carbono, podendo ser formados por 20, 60, 70, 100, 180, 240 e até 540 átomos de carbono , um icosaedro truncado de simetria Ih, e um diâmetro de aproximadamente 1 nm.

Os fulerenos são sólidos pretos; dissolvidos em solventes apropriados, formam soluções coloridas (C60, magenta; C70, vinho; C76, amarelo/verde). A exploração de suas propriedades fotofísicas e eletroquímicas pode se provar útil. O C60 absorve luz visível, formando uma espécie excitada, *C60. Essa espécie absorve mais luz (é mais preta) do que o C60, o que significa que a solução de C60 funciona como um limitador ótico (materiais que limitam a intensidade de luz transmitida a um valor máximo, convertendo em calor a luz em excesso). Se filmes finos de C60 puderem ser depositados sobre vidro e se comportarem como limitadores óticos, ele poderá ser usado para proteger equipamentos sensíveis (inclusive o olho humano) de superexposições acidentais a raios de luz (de lasers, por exemplo).
Bibliografia:
http://www.mundovestibular.com.br/articles/9142/1/Fulerenos/Paacutegina1.html
http://pt.wikipedia.org/wiki/Fulereno

Nome: Acetonitrila
Nome IUPAC: Acetonitrila
Formula Química: C2H3N
Outros nomes:cianeto de metila; cyanomethane; etílo nitrilo; ethanecarbonitrile.
Identificação do produto e da empresa:
Nome da empresa: Labsynth Produtos para Laboratórios Ltda
Identificação de perigos: Facilmente inflamável. Nocivo por ingestão, contato com a pele e por ingestão.
Medidas de primeiros-socorros:
- Inalação: Remover para local ventilado. Eventualmente, respiração artificial.
- Contato com a pele: Lavar com bastante água. Retirar as roupas contaminadas.
- Contato com os olhos: Lavar com bastante água, por 15 min. Consultar um oftalmologista.
- Ingestão: beber bastante água ou solução fisiológica. Provocar o vomito. Procurar auxílio médico.
Medidas de combate a incêndio: Meios de extinção apropriados: CO2, espuma, pó
- Perigos específicos: combustível.
Manuseio e armazenamento: - Manuseio: local arejado e/ou exaustão local
- Armazenamento: Manter em embalagem bem fechadas, local limpo e seco, longe de faíscas. Temperatura ambiente.
Leia mais na sequência do post, clicando no link a seguir:
Controle de exposição e proteção individual: - Equipamento de proteção individual apropriado:
- Proteção respiratória : máscara para solventes
- Proteção das mãos: luvas de butilo
- Proteção dos olhos: óculos de proteção
- Medidas de higiene: Depois do término do trabalho, lavar as mãos e rosto. Retirar as roupas contaminadas.
Propriedades físico-químicas
- Forma: líquido
- Cor: incolor
- Odor: odor próprio
- Temperaturas específicas ou faixas de temperaturas nas quais ocorrem mudanças de estado físico:
- Ponto de fusão: -46C (-51F) - Ponto de ebulição:81.6C (180F)
- Ponto de ignição: 524ºC
- Ponto de inflamabilidade: 2ºC
- Límite de explosão: 3,0 – 17 % v
- Densidade: 0.786 g/mL liquid
- Solubilidade: solventes orgânicos: solúvel em água.
- Índice de refração: 1,3442
Gravidade específica: 0,79 0,79 15C/4C
% Voláteis por volume a 21C (70F): 100
Densidade do vapor (Ar = 1): 1.4
Pressão de vapor (mm Hg): 73 @ 20C (68F)
Taxa de evaporação (BuAc = 1)
Ponto de fulgor:2 °C
Peso molecular:41,05
Informações ecológicas
- Degradação biológica:
Biodegradação: 98% / 28d
Facilmente biodegradável
- Comportamento esperado: não se prevê qualquer bio-acumulação
- Ecotoxicidade: Efeitos biológicos: Efeito tóxico nos peixes e no plâncton.
Toxicidade nos peixes: P.promelas LC50: 1640 mg / l / 96h
Informações sobre transporte
- Regulamentações nacionais e internacionais
- Terrestres:ONU 1648 ACETONITRILA, 3, II
- Marítimo:ONU 1648 ACETONITRILA, 3, II

Cianetos são compostos que possuem o grupo ciano (CN), Um líquido incolor.É um composto químico denominado como um solvente com formula CH3CN, quando ligados a metais são usados como inseticidas, venenos, pigmentos, na metalurgia (galvanização), e na purificação de prata e ouro, Quando ligados a compostos orgânicos são chamadosde nitrilas (=N), e são aplicados principalmente na fabricação de tecidos, plásticos e borracha sintética, largamente usada como um solvente polar aprótico em química sintética, como um solvente de fase móvel pois sua polaridade média em HPLC e LCMS, e em química orgânica na purificação de reagentes orgânicos, a acetronitrila dissolve também uma grande quantidade de compostos iônicos e não - polares. A acetonitrila (CH3CN) é a mais simples das nitrilas. Também conhecida por etanonitrila e cianeto de metila, apresenta-se como um líquido inflamável e sem cor, completamente solúvel em água e outros solventes orgânicos, com exceção dos alcanos. É usado como solvente e reagente químico, tanto em laboratório quanto na indústria

A partir de outubro de 2008, a oferta mundial de acetonitrila foi baixa porque a produção chinesa foi fechada para as Olimpíadas. Além disso, uma fábrica nos EUA foi danificada no Texas durante o furacão Ike.Devido ao abrandamento económico global, a produção de acrilonitrila, que é usado em fibras de acrílico e acrilonitrila-butadieno-estireno(ABS) resinas diminuiu. Porque acetonitrila é um subproduto da produção de acetonitrila, a sua produção também diminuiu. A escassez mundial de acetonitrila continuou até o início de 2009.

Inalação: Efeitos da superexposição são muitas vezes adiada, possivelmente devido à lenta formação de ânions cianeto no corpo. Estes ânions cianeto impedir que o corpo utiliza oxigênio e pode levar à asfixia interna. Os sintomas iniciais podem incluir a irritação do nariz e da garganta, rubor da face, e aperto no peito. As maiores concentrações pode produzir cefaléia, náusea, vômito, depressão respiratória, fraqueza, alterações no sangue, alterações da tireóide, batimento cardíaco irregular, dor abdominal, convulsões, choque, a inconsciência e morte, dependendo da concentração e tempo de exposição. Ingestão:
Podem ocorrer Outros sintomas paralelos aos da inalação gástrica.
Contato com a pele: Pode causar irritação. Pode ser absorvido através da pele, com efeitos sobre a saúde em paralelo aos da inalação.
Contato com os olhos: Os respingos podem causar irritação nos olhos, com vermelhidão e dor.
Exposição crônica: Longo prazo exposições podem afetar o fígado, rins e sistema nervoso central.
Reações nas quais a molecula pode participar:
PdCl2 + 2 CH3CN → PdCl2 (CH3CN) 2
Em química inorgânica, acetonitrila é empregado como solvente e, muitas vezes um ligante facilmente deslocável. Por exemplo, PdCl2 (CH3CN) 2 é preparado pelo aquecimento de uma suspensão de (polímeros) cloreto de paládio em acetonitrila:
-Os grupos CH3CN sofrer deslocamento rápido por muitos outros ligantes.
Coriosidades gerais:
É amplamente utilizado em aplicações de bateria por causa de sua relativamente alta capacidade de constante dielétrica e dissolver os eletrólitos. Por razões semelhantes, é um solvente popular em voltametria cíclica. A sua baixa viscosidade e baixa reatividade química fazem dele uma escolha popular para cromatografia líquida. Acetonitrila desempenha um papel significativo como solvente dominante usado na fabricação de oligonucleotídeos de DNA a partir de monômeros. Industrialmente, ele é usado como solvente na fabricação de produtos farmacêuticos e de filmes fotográficos.
bibliografia:
Autor: ASSUNPÇAO, ROSELY M V,Editora: EDGARD BLUCHER
Fontes:
http://www.profcupido.hpg.ig.com.br/nitrila.htm
http://pt.wikipedia.org/wiki/Acetonitrila
blog: http://www.agracadaquimica.com.br/index.php
http://www.jtbaker.com/msds/englishhtml/a0518.htm
http://www.inrs.fr/inrs-pub/inrs01.nsf/IntranetObject-accesParReference/FT%20104/$File/ft104.pdf

