<div
<div

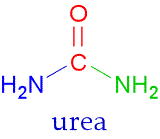
Nome:Ureia
Nome IUPAC: Diaminometanal
Nome popular: Carbamida
Descobridor: Hilaire Rouelle
Ano:1773
Formula Química: (NH2)2CO
Estado físico: Sólido cristalino em forma de perolas.
Forma: Sólido.
Cor: Branca.
Odor: Inodoro ou um leve odor de amônia.
pH: Levemente alcalino.
Temperaturas específicas:
Ponto de ebulição: Não aplicável.
Ponto de fusão: 132,7 ºC (dados de literatura).
Temperatura de auto-ignição: Não aplicável.
Limites de explosividade superior/inferior: Não aplicável
Pressão de vapor: Não aplicável.
Densidade de vapor: Não aplicável.
Densidade livre: 1,34 g/cm3.
Densidade aparente: 730 kg/m3.
Solubilidade (água): 78 g/100 ml (5 °C); 119.3 g/100 ml (25 °C).
Solubilidade (etanol): 72 g/1000 ml (30 ºC).
Coeficiente de partição octanol/água: Não aplicável.
Taxa de evaporação: Não aplicável.
Outras informações:-Peso molecular: 60,06
Identificação do produto e da empresa:
Nome da empresa: J. D. I. Comércio e Representações Ltda.
Chemical Abstract Service (nº CAS): 57-13-6
Identificação de perigos:
-Inalação: A poeira é irritante ao nariz, à garganta, e ao sistema respiratório, e pode causar tosse e espirros.
-Contato com a pele: O contato prolongado e repetido pode causar uma irritação suave.
-Contato com os olhos: Irritação, olhos vermelhos, e dor.
-Ingestão: A ingestão de quantidades grandes de poeira pode causar uma virada gastrointestinal e a dor
abdominal.
-Outros efeitos na saúde: Quando dissolvida em água assume forma de soluções corrosivas. Em
concentrações elevadas no sangue a uréia aumenta o risco do glaucoma.
Medidas de primeiros-socorros:
-Inalação: Remova a pessoa ao ar fresco. Se esta não estiver respirando, administre a respiração artificial. Se
respirar com dificuldade, administre o oxigênio. Encaminhar ao Médico.
Contato com a pele: Remova a substância da roupa. Lave as áreas afetadas com sabão. Se a irritação
persistir, procure um médico.
-Contato com os olhos: Lavar os olhos com água morna em abundância por pelo menos 15 minutos.
Encaminhar ao Médico.
Ingestão: Se a vitima não sofrer de convulsões, dar para ela 0,5 a 1L de água para diluir o material. Não
induza ao vômito, se a vitima vomitar, mantenha-a para a frente com a cabeça para baixo, vara
evitar que ela não respire sobre o vômito. Encaminhar ao médico imediatamente.
Ponto de fulgor: Não aplicável.
Ponto de auto ignição: Não aplicável.
Limites de inflamabilidade /explosividade: Não aplicável.
Procedimentos de combate ao fogo: Usar as medidas apropriadas para o combate do fogo da
circunvizinhança.
Perigos incomuns: A reação com nitratos apresenta o risco de fogo e explosão. A uréia não é um
combustível, mas se decompõem a temperaturas acima de 133°C formando vapores tóxicos.
Precauções pessoais:
Remoção de fontes de ignição: Apresenta risco de decomposição quando exposta ao calor ou chama.
Controle de poeira: Não aplicável.
Prevenção da inalação e do contato com a pele, mucosas e olhos: Utilize equipamentos de proteção
individual adequados.
Precauções ao meio ambiente: Em caso derramamento, o produto deverá ser recolhido, pois o contato
com em altas concentrações com a vegetação, causará danos à mesma. A queda em córregos ou rios deve
ser evitada, pois poderá torná-los impróprio para o consumo humano e de animais. Neste caso,
comunique o fato imediatamente ao órgão de Controle Ambiental da Região.
Sistemas de alarme: Não aplicável.
Métodos para limpeza: Em caso de vazamento pare ou reduza-o, se for seguro tomar esta ação.
Recuperação: Se possível realizar a transferência do produto.
Neutralização: Não aplicável.
Disposição: O produto é reaproveitado.
Prevenção de perigos secundários: Reveja orientações contidas nos campos anteriores.
Manuseio:
Medidas técnicas: Se as operações de manuseio gerarem a poeira ou névoa, usar ventilação para manter
a exposição aos contaminadores transportados por via aérea abaixo do limite da exposição.
Prevenção da exposição do trabalhador: Submeta todo sistema a um controle periódico de
manutenção. Mantenha equipe permanentemente treinada.
Prevenção de incêndio e explosão: Reveja orientações contidas nos campos anteriores.
Precauções para manuseio seguro: Para reduzir a possibilidade de risco potencial à saúde, assegure
ventilação diluídora suficiente ou existência de exaustão no local para controlar a concentração ambiente a
níveis baixos. Utilizar sempre os equipamentos de proteção individual.
Orientações para manuseio seguro: Evite contato com materiais incompatíveis e contaminações
ambientais, conforme mencionado nos campos anteriores.
Armazenamento:
Medidas técnicas apropriadas: Previna o contato com calor, faíscas e chamas.
Equipamento de proteção individual apropriado:
Proteção respiratória: no caso do contato apenas com a uréia, preferencialmente utilizar, mascaras
contra pó, em situações de emergência utilizar mascaras com alimentação de ar.
Proteção da pele: As luvas do algodão e a roupa protetora devem ser usadas. Proteção De Olho: Use
óculos de proteção de segurança química quando há potencial para o contato de olho.
O Outro Equipamento Protetor Pessoal: Requerido não geralmente.
Proteção de olho: Utilize óculos de segurança.
Efeitos ambientais, comportamentos e impactos do produto:
Mobilidade: A uréia é solúvel em água.
Persistência /degradabilidade: Substancialmente biodegradável em solo e água.
Bioacumulação: Baixo potencial para bioacumulação.
Comportamento esperado: Rápida dissipação da nuvem gasosa.
Impacto ambiental: Em caso de derramamento, o produto deverá ser recolhido, pois, o contato em alta
concentração com a vegetação, causará danos à mesma.A queda do produto em córregos e rios deve ser
evitada, pois poderá torná-los impróprio para o consumo humano e de animais. Neste caso, comunique o
fato imediatamente ao órgão de Controle Ambiental da Região.
Ecotoxicidade: Pouco tóxico para a vida animal e humana.
A adição da ureia se faz necessária para a solução ficar isenta de íonnitrico que impedem a deposição completa do cobre; logo, em uma solução eletrolítica a finalidade da ureia é remover vestígios dos íons nitrito.
Reação:
- 2H+ + 2NO2- + CO(NH2)2 → 2N2 + CO2 + 3H2O
Referências bibliográficas:
- Guidance for Compilation of Safety Data Sheets for Fertilizer Materials. European Fertilizer
Manufacturers’ Association (EFMA), 1996.
- Portaria Nº 3.214, Do Ministério do Trabalho.
- NIOSH, OSHA, ACGIH.
- NFPA
Nome IUPAC: Ácido 2-amino-3-fenil-propanoico
Outros nomes: Ácido α-amino-β-fenil-propiônico
Fórmula molecular: C9H11NO2
Massa molecular: 165.18 g mol-1
Ponto de fusão: 275–283 °C
Solubilidade: em água, metanol e etanol

Descoberta
No início da década de 60 já estava bem estabelecido que existia uma colinearidade entre a seqüência de nucleotídeos presente no mRNA e a seqüência de aminoácidos da proteína que seria produzida. Nessa época ainda não se sabia exatamente como ocorria a transformação de uma seqüência de nucleotídeos em uma seqüência de aminoácidos - ou seja, como era o processo de tradução da informação genética (síntese de proteína).
Sabia-se que cada três nucleotídeos do RNA (trincas ou códons) correspondiam à introdução de um aminoácido na proteína. O grande problema era descobrir que combinação de três bases era necessária para introduzir um aminoácido específico (Qual era o significado de cada códon?). Por exemplo, para produzir uma seqüência de aminoácidos formada por Lys-Hist-Val, que nucleotídeos deveriam estar presentes no mRNA ? Essa questão só poderia ser respondida depois que o código genético fosse quebrado; ou seja, depois que se descobrisse o significado de cada uma das 64 trincas de nucleotídeos que podiam aparecer no mRNA.
Utilizando mRNAs artificiais (sintetizados in vitro) e um sistema de tradução também realizado in vitro , foi possível descobrir que um mRNA contendo apenas uracilas (UUUUUUUUU ...) originava uma cadeia polipeptídica formada apenas por fenilalaninas (...Phe-Phe-Phe...). Obviamente, a trinca UUU era o códon para a fenilalanina. A descoberta do significado de todos os códons foi concluída em 1965. O resultado dessa descoberta é normalmente apresentado sob forma de um quadro com tripla entrada, que permite que se converta qualquer seqüência de RNA em uma seqüência de aminoácidos (Quadro 3.3 - Thompson & Thompson, p.33).
Curiosidades
A fenilanina é encontrada no aspartame um adoçante, substituto do açúcar e muito utilizado em bebidas, principalmente em refrigerantes.
A fenilanina é um amino ácido, um dos blocos de construção das proteínas. É um composto natural que esta presente em todas as proteínas (vegetais ou animais). O corpo humano necessita da fenilalanina, pois é uma parte integral de todas as proteínas do nosso corpo. Os humanos não conseguem sintetizar a fenilalanina, logo é um componente essencial da nossa dieta diária, sem ela o corpo não consegue funcionar.
A feniceltonúria é uma doença relacionada a uma alteração genética rara que envolve o metabolismo de proteínas. É caracterizada por uma anomalia congênita em que a falta de uma enzima no organismo torna-o incapaz de metabolizar o aminoácido fenilalanina que é encontrado naturalmente nas proteínas animais ou vegetais, como peixes, leguminosas e no aspartame. (2,4).
Fontes:
http://www.rgnutri.com.br/sqv/patologias/fna.php
http://www.food-info.net/pt/qa/qa-fi12.htm
Em química, a acetona (também conhecida como dimetilcetona, 2-propanona, propan-2-ona ou simplesmente propanona) com fórmula química CH3(CO)CH3, é um composto orgânico sintético que também ocorre naturalmente no meio ambiente. É um líquido incolor de odor e sabor fáceis de distinguir. Evapora facilmente, é inflamável e solúvel em água.
Nome usual: Acetona
Formula Estrutural:

Nomes Usuais da IUPAC: Acetona (propanona ou dimetil cetona)
Fórmula: CH3(CO)CH3
Densidade: 0,79 g·cm-3 (20 °C)
Ponto de fusão: -95C
Ponto de ebulição:56.5C
Reatividade:0
Inflamabilidade:3
Nome do descobridor: Wilhelm Michler (1846-1889), descobridor da cetona aromática. Em 1884, foi contratado para a cadeira de Química Industrial na Escola Politécnica. Michler transformou o modesto Laboratório de Química numa ala própria com laboratórios onde formou numerosos alunos e executou pesquisas sobre produtos naturais brasileiros.
Uso da molécula: A acetona é utilizada como solvente em esmaltes, tintas e vernizes; na extração de óleos e na fabricação de fármacos. Possui emprego na indústria de explosivos como gelatinizaste da pólvora sem fumaça (nitro celulose) e como produto inicial de sínteses químicas, em especial na industria farmacêutica.

Risco ao organismo:
A inalação dos vapores irritam as vias respiratórias. Pode causar tosse tonturas e dor de cabeça. Em maiores concentrações pode produzir depressão do sistema nervoso central e inconsciência. A ingestão de grandes quantidades pode produzir dores abdominais náuseas e vômitos. A aspiração para os pulmões pode produzir dano pulmonar grave. Contato com os olhos: Os vapores são irritantes para os olhos. Os respingos podem causar irritação grave , lacrimeja mento , vermelhidão e dor. Exposição crônica: O contato prolongado ou repetido com a pele pode causar irritação grave ou dermatite.

As propriedades da Cafeína são:
Formula molecular: C8H10N4O2.
Massa molar: 194.19 g/mol (nas seguintes proporções: 49,48% de Carbono, 5,19% de Hidrogênio, 28,85% de azoto e 16,48% de Oxigênio.
Densidade: 1,23 g·cm-3
Ponto de fusão: 238 °C (460 F).
Ponto de ebulição: 178º C (352 F).
pH: 6,9( em uma solução a 1%).
A sua densidade é de 1,23 e apresenta uma volatilidade de 0,5%. Apresenta um pH de 6,9 em uma solução a 1%. A cafeína apresenta uma temperatura de auto-ignição de 925 ºC (1697 F).
Inflamabilidade: baixa.
Alguns antropologistas pensam que o primeiro uso da cafeína, incluída nas plantas, remonta a 600 mil anos a.C. (Idade da Pedra), no entanto, a sua descoberta acredita-se ter sido feita na Etiópia (antiga Abissínia), em torno de 700 a.C., onde a planta crescia naturalmente.
As primeiras plantações de café designadas por “Kaweh” apareceram na península Arábica, no século XIV, e eram usadas como alimento, na fabricação de vinho, como remédio e para fazer uma bebida árabe denominada “qahwa”, conhecida por prevenir o sono.
Na Europa, o café apareceu no século XVI sendo introduzido, principalmente, pelos espanhóis e holandeses, no período das descobertas. Antes disso, o café era consumido de maneira restrita e a bebida nobre era o chá. Inicialmente, o café encontrou uma forte oposição em alguns países protestantes, como a Alemanha, Áustria e Suíça, nações essas que chegaram mesmo a castigar o comércio e o seu consumo.
Com o passar do tempo, todas as proibições acabaram por desaparecer na Europa e, a partir da segunda metade do século XVII, o café converteu-se em sinônimo de bebida intelectual, devido à existência de muitos comércios que ofereciam espaços públicos para consumi-lo, em todas as grandes cidades. Consta que, em França, os cafés se tornaram locais de reunião dos intelectuais, entre eles Victor Hugo, Voltaire, Rousseau.
Em 1736, surgem as primeiras plantações na América Latina, nomeadamente, em Porto Rico e cerca de 20 anos depois era já o principal produto de exportação do país, o que acontece até aos nossos dias.
O primeiro protótipo de uma máquina de café expresso foi criado em França, em 1822, mas só em 1905 surge um modelo comercial em Itália. O descafeinado é descoberto na Alemanha em 1903 após investigações que visavam obter um processo que permitisse remover a cafeína sem destruir o verdadeiro sabor do café.
Em 1938, o café instantâneo (Nescafé) é inventado pela companhia Nestlé que pretendia ajudar o governo brasileiro a escoar o seu excedente de café.
Atualmente, a cafeína é consumida por bilhões de pessoas no mundo, estando este hábito inserido em diversas e variadas práticas culturais, sendo até vital para a economia de alguns países.
Curiosidades
-É usada como estimulante do sistema nervoso central. Altas doses de cafeína excitam demasiadamente o sistema nervoso central, inclusive os reflexos medulares, podendo ser letal. Estudos demonstraram que a dose letal para o homem é, em média, de 10 gramas.
-É uma substância incluída nos regulamentos de dopping de todas as federações desportivas (doses de 12 mcg/ml) já podem ser consideradas dopping. Essa quantidade é facilmente atingida a partir da quarta xícara de café.
-Em excesso pode provocar: nervosismo, irritabilidade, estado de ansiedade e, em alguns casos, tremuras nas mãos.
-Novos estudos têm associado à cafeína ao tratamento de algumas doenças, mostrando já haver algum efeito positivo na prevenção do Mal de Parkinson e na prevenção de cancro de pulmão entre os fumantes.
- O etanol é bem menos poluente em comparação aos combustíveis fósseis (derivados do petróleo; diesel e gasolina). É usado nos automóveis brasileiros há mais de 20 anos. Além de ser uma fonte de energia renovável;
- O Brasil hoje é o maior exportador mundial de etanol, com 430 usinas produtoras concentradas basicamente na região centro-sul do País. Cerca de 60% da produção está localizada no estado de São Paulo e outros 10% distribuídos na região Nordeste;
- O etanol brasileiro hoje é exportado para EUA, Japão, Jamaica, Nigéria, Coréia do Sul, Suécia, Países Baixos, Costa Rica, El Salvador e México, além de países da União Européia;
- Alguns países já estão adicionando o etanol à gasolina como forma de diminuir a emissão de poluentes e o efeito estufa;
- O consumo de etanol em vez da gasolina só compensa economicamente para o consumidor quando o valor do álcool é de, no máximo, 70% do preço da gasolina;
- No Brasil é utilizado a cana-de-açúcar para a produção de etanol, enquanto que nos Estados Unidos e no México é utilizado o milho;

(sacarose) (glicose) (frutose)
C6H12O6 + C6H12O6 ------------ 4C2H5OH + 4CO2
(glicose) (frutose) (etanol) (gás carbônico)
Reações que a molécula de etanol pode participar:

O metabolismo do álcool etílico consiste basicamente na sua oxidação, passando por aldeído acético (C2H4O) e, em seguida, ácido acético (C2H4O2), até formar gás carbônico (CO2) e água (H2O).

Essas são apenas algumas das reações que o etanol pode participar.



O peróxido de hidrogênio foi descoberto pelo francês Louis-Jacques Thénard em 1818. Desde a metade do Século XVIII ele vem sendo usado como um agente alvejante não-poluente, pois em questões ambiental apresenta-se como um reagente único, visto que seu produto de decomposição é a água.

- · Água oxigenada
- · Dióxido de Hidrogênio
- · Hidroperóxido
- · Peróxido de Hidrogênio
Dados específicos:
- · Forma molecular: H2O2
- · Massa molar: 34g/mol
- · Ponto de ebulição: 414K ou 141°C
- · Ponto de fusão: 262K ou -11°C
- · Densidade: 1,476 g/cm³
- · Solubilidade: em água e solventes orgânicos polares.
O peróxido de hidrogênio é produzido a partir da substância antraquinona e solventes, o hidrogênio é adicionado na molécula de antraquinona, logo ocorre à oxidação com o ar para produção do peróxido de hidrogênio, ou seja, a antraquinona é usada como catalisador, onde ocorre a redução do oxigênio pelo hidrogênio. Este processo é ainda hoje bastante usado, porém exige larga disponibilidade de hidrogênio além de uma grande quantidade de solvente não-aquoso para permitir que se recicle o catalisador. Existe outro procedimento para a produção do peróxido de hidrogênio, há eletrolise da solução a 50 % de H2SO4, obtendo uma solução 20%.
Utilizações recomendadas da molécula H2O2:
- · Anticéptico, desinfetante, esterilizante: usado em ferimentos;
- · Estético: descolorante de cabelos, tratamentos dentários clareamento;
- · Industrial: no processo de clareamento do papel, celulose, tecidos, eletrônica, em procedimentos químicos.
- · Agentes odoríferos;
- · Agentes oxidantes;
- · Tratamento de água e metais;
Comercialmente a molécula de H2O2 é encontrada dividida por volumes:
- · 10 Volumes: isso quer dizer 3% de hidrogênio na solução este é o volume mais comum de se encontrar em farmácias, pois contem 50% de peróxido super diluído, e o 50% restante é composto por estabilizantes, como: fenol, acetanilina, entre outros. Este volume é indicado para uso medico e na higienização da casa e alimentos.
- · 20 volumes: 6% de hidrogênio usado como descolorante de cabelos.
- · Concentrado: 30% de hidrogênio é corrosivo, pode causar queimaduras graves, ele pode ser usado como reagente, mas deve ser ter muito cuidado, evite usá-lo em lugar sem ventilação, e armazene em lugar arejado.
|
|
|||||
Curiosidades:
A água oxigenada foi desenvolvida na década de 1920 por cientistas
para conter problemas de infecções e gangrena em soldados em frente de batalha. A pesquisa buscava um produto barato, fácil de transportar e usar, que pudesse ser conservado de forma fácil e à temperatura ambiente, sem problemas colaterais. Durante a segunda guerra mundial, a redução no número de baixas e amputações foi tremenda, graças ao uso da água oxigenada. O
peróxido de hidrogênio a 90% é usado como combustível para ajustes na trajetória e órbitas de satélites, combustível de foguetes, nesse caso ele é altamente perigoso e explosivo
.