



Oi Pessoal à molécula dessa semana vai ser um pouco diferente, de vez ser em forma de texto, vai ser nessa forma que vocês estão vendo de slides espero que vocês aprovem.


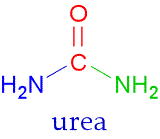
Nome:Ureia
Nome IUPAC: Diaminometanal
Nome popular: Carbamida
Descobridor: Hilaire Rouelle
Ano:1773
Formula Química: (NH2)2CO
Estado físico: Sólido cristalino em forma de perolas.
Forma: Sólido.
Cor: Branca.
Odor: Inodoro ou um leve odor de amônia.
pH: Levemente alcalino.
Temperaturas específicas:
Ponto de ebulição: Não aplicável.
Ponto de fusão: 132,7 ºC (dados de literatura).
Temperatura de auto-ignição: Não aplicável.
Limites de explosividade superior/inferior: Não aplicável
Pressão de vapor: Não aplicável.
Densidade de vapor: Não aplicável.
Densidade livre: 1,34 g/cm3.
Densidade aparente: 730 kg/m3.
Solubilidade (água): 78 g/100 ml (5 °C); 119.3 g/100 ml (25 °C).
Solubilidade (etanol): 72 g/1000 ml (30 ºC).
Coeficiente de partição octanol/água: Não aplicável.
Taxa de evaporação: Não aplicável.
Outras informações:-Peso molecular: 60,06
Identificação do produto e da empresa:
Nome da empresa: J. D. I. Comércio e Representações Ltda.
Chemical Abstract Service (nº CAS): 57-13-6
Identificação de perigos:
-Inalação: A poeira é irritante ao nariz, à garganta, e ao sistema respiratório, e pode causar tosse e espirros.
-Contato com a pele: O contato prolongado e repetido pode causar uma irritação suave.
-Contato com os olhos: Irritação, olhos vermelhos, e dor.
-Ingestão: A ingestão de quantidades grandes de poeira pode causar uma virada gastrointestinal e a dor
abdominal.
-Outros efeitos na saúde: Quando dissolvida em água assume forma de soluções corrosivas. Em
concentrações elevadas no sangue a uréia aumenta o risco do glaucoma.
Medidas de primeiros-socorros:
-Inalação: Remova a pessoa ao ar fresco. Se esta não estiver respirando, administre a respiração artificial. Se
respirar com dificuldade, administre o oxigênio. Encaminhar ao Médico.
Contato com a pele: Remova a substância da roupa. Lave as áreas afetadas com sabão. Se a irritação
persistir, procure um médico.
-Contato com os olhos: Lavar os olhos com água morna em abundância por pelo menos 15 minutos.
Encaminhar ao Médico.
Ingestão: Se a vitima não sofrer de convulsões, dar para ela 0,5 a 1L de água para diluir o material. Não
induza ao vômito, se a vitima vomitar, mantenha-a para a frente com a cabeça para baixo, vara
evitar que ela não respire sobre o vômito. Encaminhar ao médico imediatamente.
Ponto de fulgor: Não aplicável.
Ponto de auto ignição: Não aplicável.
Limites de inflamabilidade /explosividade: Não aplicável.
Procedimentos de combate ao fogo: Usar as medidas apropriadas para o combate do fogo da
circunvizinhança.
Perigos incomuns: A reação com nitratos apresenta o risco de fogo e explosão. A uréia não é um
combustível, mas se decompõem a temperaturas acima de 133°C formando vapores tóxicos.
Precauções pessoais:
Remoção de fontes de ignição: Apresenta risco de decomposição quando exposta ao calor ou chama.
Controle de poeira: Não aplicável.
Prevenção da inalação e do contato com a pele, mucosas e olhos: Utilize equipamentos de proteção
individual adequados.
Precauções ao meio ambiente: Em caso derramamento, o produto deverá ser recolhido, pois o contato
com em altas concentrações com a vegetação, causará danos à mesma. A queda em córregos ou rios deve
ser evitada, pois poderá torná-los impróprio para o consumo humano e de animais. Neste caso,
comunique o fato imediatamente ao órgão de Controle Ambiental da Região.
Sistemas de alarme: Não aplicável.
Métodos para limpeza: Em caso de vazamento pare ou reduza-o, se for seguro tomar esta ação.
Recuperação: Se possível realizar a transferência do produto.
Neutralização: Não aplicável.
Disposição: O produto é reaproveitado.
Prevenção de perigos secundários: Reveja orientações contidas nos campos anteriores.
Manuseio:
Medidas técnicas: Se as operações de manuseio gerarem a poeira ou névoa, usar ventilação para manter
a exposição aos contaminadores transportados por via aérea abaixo do limite da exposição.
Prevenção da exposição do trabalhador: Submeta todo sistema a um controle periódico de
manutenção. Mantenha equipe permanentemente treinada.
Prevenção de incêndio e explosão: Reveja orientações contidas nos campos anteriores.
Precauções para manuseio seguro: Para reduzir a possibilidade de risco potencial à saúde, assegure
ventilação diluídora suficiente ou existência de exaustão no local para controlar a concentração ambiente a
níveis baixos. Utilizar sempre os equipamentos de proteção individual.
Orientações para manuseio seguro: Evite contato com materiais incompatíveis e contaminações
ambientais, conforme mencionado nos campos anteriores.
Armazenamento:
Medidas técnicas apropriadas: Previna o contato com calor, faíscas e chamas.
Equipamento de proteção individual apropriado:
Proteção respiratória: no caso do contato apenas com a uréia, preferencialmente utilizar, mascaras
contra pó, em situações de emergência utilizar mascaras com alimentação de ar.
Proteção da pele: As luvas do algodão e a roupa protetora devem ser usadas. Proteção De Olho: Use
óculos de proteção de segurança química quando há potencial para o contato de olho.
O Outro Equipamento Protetor Pessoal: Requerido não geralmente.
Proteção de olho: Utilize óculos de segurança.
Efeitos ambientais, comportamentos e impactos do produto:
Mobilidade: A uréia é solúvel em água.
Persistência /degradabilidade: Substancialmente biodegradável em solo e água.
Bioacumulação: Baixo potencial para bioacumulação.
Comportamento esperado: Rápida dissipação da nuvem gasosa.
Impacto ambiental: Em caso de derramamento, o produto deverá ser recolhido, pois, o contato em alta
concentração com a vegetação, causará danos à mesma.A queda do produto em córregos e rios deve ser
evitada, pois poderá torná-los impróprio para o consumo humano e de animais. Neste caso, comunique o
fato imediatamente ao órgão de Controle Ambiental da Região.
Ecotoxicidade: Pouco tóxico para a vida animal e humana.
A adição da ureia se faz necessária para a solução ficar isenta de íonnitrico que impedem a deposição completa do cobre; logo, em uma solução eletrolítica a finalidade da ureia é remover vestígios dos íons nitrito.
Reação:
Referências bibliográficas:
- Guidance for Compilation of Safety Data Sheets for Fertilizer Materials. European Fertilizer
Manufacturers’ Association (EFMA), 1996.
- Portaria Nº 3.214, Do Ministério do Trabalho.
- NIOSH, OSHA, ACGIH.
- NFPA
Oi pessoal, tudo bem?
Hoje, dia 30/03, vamos começar a trabalhar na criação de apresentações de qualidade.Vocês podem usar o Microsoft PowerPoint ou a ferramenta de apresentação do Google Docs.Caso optem por usar a segunda opção, vocês terâo a vantagem de compartilhar um documento entre vários autores e, o que é melhor, poderão comentar as alterações feitas por todos os membros do grupo.Para auxiliar nessa tarefa, selecionei uma apresentação que dá dicas do que fazer ou do que não fazer em uma apresentação.http://www.slideshare.net/sylvioros/magic-powerpoint2-presentation"
E tem esse artigo da revista PcWorld online que dá mais dicas legais para vocês.
Espero que essas dicas sejam úteis. Agora, mãos à obra e bom trabalho.
A tarefa é fazer um post para o nosso blog na categoria "molécula da semana", só que com a diferença de que o conteúdo do post deve estar em um powerpoint ou em uma apresentação gerada no Google Docs.É mister ouvir o grito da tecnologia. Sua presença está, cada vez mais, arraigada em nossa cultura atual. O computador, por sua vez, tornou-se aliado, e muitas vezes substituto, do próprio homem. Negar a sua exitência, ou negar-se simplesmente a buliná-lo, é negar, hoje, a própria maneira de ser da sociadade do século XXl. Dessa forma, o professor surge como ponto chave, ou pelo menos assim deveria ser, num conflito que, por muitas das vezes, coloca o homem, não como usuário,e sim como vítima, isto é, o modo de vida e produção atuais não mais dá espaço às pessoas não afeitas a trabalhar com computadores. Esse mesmo mercado de trabalho, mais, mais e mais exige pessoas capacitadas a manusearem as tecnologias existentes, e mais, aptas a que se adequem às novas tecnologias que, praticamente, nos são lançadas diariamente pelo mercado. Nesse contexto, o professor sabendo usar as ferramentas tecnológicas que estão à disposição, estará cada vez mais perto, se bem que a plenitude aqui seja utópica, da perfeição, que é, formar cidadãos que estejam preparados para o mercado de trabalho tanto quanto para serem pessoas plenas, conscientes, completas, e que saibam que estão inseridas em um contexto social, dinâmico e mutável.


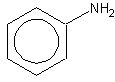
Nome IUPAC: Aminobenzeno
Outros nomes: Fenilamina, Anilina
Fórmula molecular: C6H7N
Aparência: líquido incolor
Densidade: 1.0217 g/ml, líquido
Ponto de fusão: −6.3 °C
Ponto de ebulição: 184.13 °C

Características:
A anilina pertence à classe orgânica das amidas e foi descoberta em 1826 por Otto Unverdorben (1806-1873) quando tinha apenas 20 anos, tendo a chamado primeiro de Crystallin e foi inicialmente preparada a partir da destilação seca do anil ou do índigo.
É um composto orgânico um líquido incolor ligeiramente amarelo, tem odor de peixe podre, característico de aminas aromáticas, sabor cáustico de veneno amargo. Facilmente inflamável é levemente solúvel em água, se dissolve na maioria dos compostos orgânicos.
A Anilina é uma substância muito venenosa, ocorre no alcatrão mineral, sendo utilizada na indústria da borracha e na síntese de fármacos e corantes. Esses corantes possuem cores intensas, um exemplo é o azul-de-metileno que é usado no coramento de células para serem vistas ao microscópio. A Anilina é também usada na produção de sais de diazônio e de medicamentos.
Como todo composto aromático, a anilina possui vapores tóxicos se inalados. Ela pode se combinar com a hemoglobina do sangue impedindo que o oxigênio seja transportado. Como todo composto aromático, a anilina queima rapidamente gerando uma chama muito ampla.

Reações
A anilina é uma base fraca, recebendo um H+ no grupamento NH2 que se torna NH3+. Isso faz com que ela reaja bem com diversos ácidos fortes, que geralmente são inorgânicos.
A anilina pode sofrer reações de diversos tipos, algumas delas até mesmo espontâneas, como a oxidação que ocorre caso se deixe o frasco de anilina aberto fazendo com que ela adquira uma coloração que vai de amarelo escuro a marrom.
Uma reação conhecida desse composto é a diazotação, responsável pela formação de sais de diazônio que são essenciais na síntese de corantes. Sendo um composto muito versátil, pode tomar parte em diversas reações como substituição eletrofílica direto no carbono. As reações que podem ocorrer no Nitrogênio são as reações de ácido-base, N- alquilação com etanol. Pode também ser reagido com nitrobenzeno (seu precursor para a formação de fenazina).
Sua produção se dá principalmente a partir da nitração do benzeno. Essa reação em laboratório é feita pela adição lenta de mistura sulfonítrica sobre o benzeno. Deve-se mantê-lo resfriado com banho de gelo já que essa é uma reação extremamente exotérmica. Como característica geral dos compostos nitrados, ele agora apresenta uma coloração amarelada. Essa etapa gera o nitrobenzeno, que é hidrogenado em altas temperaturas.

Curiosidades
A anilina é um químico importante na indústria da borracha. São usados em menores quantidades na produção de tintas, pesticidas, fármacos, resinas, vernizes, perfumes, químicos fotográficos, explosivos, difenilamina, fenóis e químicos usados na refinação de petróleo.
A população em geral pode estar exposta à anilina ao comer alimentos ou beber água que a contenham, no entanto as concentrações são geralmente muito pequenas quando comparadas com a anilina que se detecta quer no fumo do tabaco como em fábricas onde produtos como tintas, vernizes, herbicidas e explosivos são produzidos.
A anilina pode exercer toxicidade ao ser ingerido, inalada ou por simples contato com a pele. A anilina provoca metahemoglobinemia, pelo que o transporte de oxigênio pelo sangue é diminuído. A gravidade depende da quantidade e tempo de exposição à anilina. Este figura como sendo o sintoma mais significativo produzindo cianose (coloração azul púrpura da pele), náuseas, vômitos e diminuição da função respiratória. Podem também ocorrer dores de cabeça, irritabilidade, confusão, fraqueza, bem como sonolência. O contato direto com anilina pode produzir irritação da pele e dos olhos.
Fontes:
http://pt.wikipedia.org/wiki/Anilina
http://www.mundoeducacao.com.br/quimica/anilina.htm
http://www.infoescola.com/compostos-quimicos/anilina/
Nome usual: Formaldeído
Sinônimo: Formol, Aldeído Metílico, Óxido de Metileno, Metanal
O que é Formaldeído?
O formol ou formaldeído é uma substância utilizada para a conservação de outras substâncias e até de tecidos, utilizado principalmente em biópsias para impedir a degradação antes da análise. Por ser facilmente absorvido pelas mucosas pode ocasionar problemas sérios para a saúde.

Imagem de um processo de mumificação química
É um composto líquido claro com várias aplicações, sendo usado normalmente como preservativo, desinfetante e anti-séptico.

Imagem de um germicida utilizado na desinfecção de ambientes ou objetos. Desinfetante para aparelhagem de hemodiálise e endoscopias.
Também é usado para embalsamar peças de cadáveres, mas é útil também na confecção de seda artificial, celulose, tintas e corantes, soluções de uréia, tiouréia, resinas melaínicas, vidros, espelhos e explosivos.


Imagens de um tubarão suspenso em formol
O formol também pode ser utilizado para dar firmeza nos tecidos, na confecção de germicidas, fungicidas agrícolas, na confecção de borracha sintética e na coagulação da borracha natural, é empregado no endurecimento de gelatinas, albuminas e caseínas. É também usado na fabricação de drogas e pesticidas.

O neoprene é um tipo de borracha sintética
Os perigos do uso de formol:
Na escova progressiva - A Anvisa regulamenta os produtos cosméticos com o único objetivo de proteger a saúde dos usuários, portanto, até que se prove o contrário, o formol em percentual elevado, acima de 0,2%, não deverá conseguir registro junto ao Ministério da Saúde. Os agentes de saúde não podem ser coniventes com os danos que este produto pode vir a causar em pessoas desavisadas.

Por isso a condenação do uso de formol na escova progressiva. Além de causar danos à saúde, danifica a cutícula dos cabelos, que é a parte mais externa dos fios, e deixa o córtex, a parte interna, bastante vulnerável ao ressecamento e perda da cor. A quantidade de formol liberada pela Anvisa é de 0,2%, com a função de conservante.

Em caso de derramamento deve-se usar papel absorvente para retirada do líquido. Deve-se retirar toda a roupa contaminada e colocá-la em recipiente adequado para ser descontaminação Caso tenha havido contato com a pele, deve-se lavar a superfície com sabão e água.
Estrutura química:


Nome IUPAC: Metanal
Fórmula: CH2O
Peso molecular: 30.03 g.mol−1
Número de registro CAS: 30.0260
Ponto de Fusão: -117°C (156K)
Ponto de Ebulição: -19.3°C (253.9K)
Densidade: 1 kg·m−3 gás
Toxicidade: O formol é tóxico quando ingerido, inalado ou quando entra em contato com a pele, por via intravenosa, intraperitoneal ou subcutânea. Em concentrações de 20 ppm (partes por milhão) no ar causa rapidamente irritação nos olhos. Sob a forma de gás é mais perigoso do que em estado de vapor.
Riscos: O formol é um composto químico com enorme capacidade de redução, especialmente na presença de álcalis. É incompatível com amônia, álcalis, tanino, bissulfeto, preparações à base de ferro, prata, potássio e iodo. Reage com albumina, caseína, formando compostos insolúveis. É violentamente reativo com óxidos, nitrometano, carbonato de manganês e peróxidos.
Solubilidade: > 100g/100 ml (20°C)
Inflamabilidade: Este composto tem seu flash point em 85 C0. É um composto combustível.
Estabilidade: Pode se transformar em nuvem especialmente em baixas temperaturas. Pode sofrer oxidação na presença do ar e da luz.
Quer saber mais? Continue lendo clicando no link a seguir:
Quem descobriu e sintetizou o fenol?
Wöhler sintetizou a uréia
Butlerov descobriu o formol em 1859. O formol ou formaldeído é um gás de odor pungente e irritante.
Uso e efeitos dessa molécula sobre o organismo:
A inalação deste composto pode causar irritação nos olhos, nariz, mucosas e trato respiratório superior. Em altas concentrações pode causar bronquite, pneumonia ou laringite.

Os sintomas mais freqüentes no caso de inalação são fortes dores de cabeça, tosse, falta de ar, vertigem, dificuldade para respirar e edema pulmonar. O contato com o vapor ou com a solução pode deixar a pele esbranquiçada, áspera e causar forte sensação de anestesia e necrose na pele superficial. Longos períodos de exposição podem causar dermatite e hipersensibilidade, rachaduras na pele (ressecamento) e ulcerações principalmente entre os dedos; podem ainda causar conjuntivite.

Imagem sem conjuntivite e com conjuntivite
O vapor de formaldeído irrita todas as partes do sistema respiratório superior e também afeta os olhos. A maioria dos indivíduos pode detectar o formol em concentrações tão baixas como 0.5 ppm e, conforme for aumentando a concentração até o atual limite de Exposição Máxima, a irritação se dá mais pronunciada. A freqüente ou prolongada exposição pode causar hipersensibilidade, levando às dermatites. O contato repetido ou prolongado pode causar reação alérgica, debilitação da visão e aumento do fígado.

Imagem com aumento do baço e do fígado.
Curiosidade a respeito do Formol:
Quando se prepara uma mistura de mais de 40% de formol em água, se polimeriza um pó branco, insolúvel, que é chamado de metaformaldeído, de fórmula (H2C2O)3. Por este motivo o formol é comercializado em concentração de cerca de 37% de aldeído e 7 % de metanol, que atuará como um inibidor de polimerização.

Imagem dos componentes do cigarro e suas respectivas "utilidades"
Acetona: removedor de esmalte
Terebentina: sustância que dilui tinta a óleo
Formol: conservante de cadáver
Amônia: desinfetante para pisos, azulejos e privadas
Naftalina: eficiente mata-baratas
Fósforo p4/p6: usado em veneno para ratos.
Quando um cigarro é acesso algumas substâncias são inaladas pelo fumador e outras se difundem pelo ambiente. Essas substâncias são nocivas à saúde.
O fumo do cigarro é constituído por quase 5 mil substâncias tóxicas, dessas substâncias, 80 são cancerígenas, a nicotina, o monóxido de carbono e o alcatrão são algumas dessas substancias. Nicotina - considerada droga pela OMS é uma droga psicoativa e é responsável pela dependência do fumador. Atua ao nível do sistema nervoso central diminui a chegada do sangue aos tecidos e causa dependência química. Monóxido de Carbono (CO) - diminui a quantidade do oxigênio no sangue. Alcatrão: é altamente cancerígeno, dando início à formação de tumores.
Referências Bibliográficas: